Research Article - (2024) Volume 19, Issue 2
OPTIMAL DOSAGE OF HIIT AND ITS IMPACT ON VO2MAX IN PATIENTS WITH HEART FAILURE: A SYSTEMATIC REVIEW
Prof. Mauro Ernesto Tauda1*, Dr. Eduardo Joel Cruzat2 and Prof. Felipe Ignacio Suarez2*Correspondence: Prof. Mauro Ernesto Tauda, Deprote santo tomas, ismael vadivia, Chile, Email:
Abstract
Introduction: HIIT has been proposed as an effective strategy in cardiac rehabilitation; however, the lack of clarity regarding optimal dosage may be a limiting factor in its clinical application. Objectives: The objective of this systematic review is to determine the optimal dosage of HIIT and its impact on Vo2max in patients with heart failure.
Methods: A search was carried out in 5 databases (PubMed, Scopus, Web of Science, Cochrane Library and Medline). Studies that used the HIIT protocol and measured Vo2max were included. And they compared HIIT with MICT, SID or some strength program in patients with HF.
Results: The results of an analysis that included 6 studies with a total of 505 participants with left ventricular ejection fraction (LVEF) between 35% and 50% compared high-intensity interval training (HIIT) with other exercise methods. The studies showed that the Frequency of Sessions: Varied between 3 and 5 times per week. Session Duration: Between 28 and 47 minutes. Total Duration of Programs: Between 12 and 54 weeks. The effectiveness of the training was measured with parameters such as Vo2max, resting heart rate, power in watts, maximum force in one repetition (1RM), and peak oxygen consumption. The results suggest that HIIT is more effective in improving Vo2max than other methods, and this effectiveness is maintained regardless of the type of heart failure: reduced, moderately reduced or preserved.
Conclusion: The findings of the systematic review support the effectiveness of HIIT as an exercise training option for patients with HF.
Resumen
Introducción:
El HIIT se ha propuesto como estrategia efectiva en la rehabilitación cardíaca, sin embargo, la falta de claridad sobre la dosificación óptima puede ser un factor limitante en su aplicación clínica.
Objetivos: El objetivo de esta revisión sistemática es determinar la dosificación óptima del HIIT y su impacto en el Vo2max en pacientes con insuficiencia cardíaca.
Métodos: Se llevó a cabo una búsqueda en 5 bases de datos (PubMed, Scopus, Web of Science, Cochrane Library y Medline). Se incluyeron los estudios que usaban el protocolo HIIT y midieron el Vo2max. Y que comparaban HIIT con MICT, SID o algún programa de fuerza en pacientes con IC.
Resultados
Los resultados de un análisis que incluyó 6 estudios con un total de 505 participantes con fracción de eyección ventricular izquierda (FEVI) entre 35% y 50% compararon el entrenamiento de intervalos de alta intensidad (HIIT) con otros métodos de ejercicio. Los estudios mostraron que la Frecuencia de Sesiones: Variaba entre 3 y 5 veces por semana. Duración de las Sesiones: Entre 28 y 47 minutos. Duración Total de los Programas: Entre 12 y 54 semanas. Se midió la eficacia del entrenamiento con parámetros como Vo2max, frecuencia cardíaca en reposo, potencia en vatios, fuerza máxima en una repetición (1RM), y pico de consumo de oxígeno. Los resultados sugieren que el HIIT es más efectivo para mejorar el Vo2max que otros métodos, y esta efectividad se mantiene independientemente del tipo de insuficiencia cardíaca: reducida, moderadamente reducida o preservada.
Conclusión: Los hallazgos de la revisión sistemática respaldan la eficacia del HIIT como una opción de entrenamiento físico para pacientes con IC.
Palabras claves: Entrenamiento, enfermedades cardiovasculares, falla cardiaca.
Keywords
Training. Cardiovascular diseases. Heart failure
Introduction
La insuficiencia cardíaca se caracteriza como un estado fisiopatológico y clínico que presenta fenotipos progresivos, multifactoriales y heterogéneos, lo que dificulta que el corazón responda adecuadamente a las demandas de irrigación periférica o funcione con presiones de llenado elevadas (Bauersachs et al., 2022). Esta condición se confirma mediante niveles elevados de péptido natriurético (NP) o mediante evidencia objetiva de congestión pulmonar o sistémica cardiogénica, según los métodos de diagnóstico utilizados (Bozkurt et al., 2021; Chung et al., 2017; Pascual et al., 2016).
La insuficiencia cardíaca puede originarse debido a diversas alteraciones en componentes cardíacos clave, como el pericardio, el miocardio, los fibroblastos cardíacos, las células endoteliales, las válvulas, o ciertas anormalidades metabólicas. (McGregor et al., 2023). Las causas subyacentes pueden incluir factores idiopáticos, infecciones virales, consumo de alcohol, quimioterapia, edad avanzada, hipertensión, diabetes, dislipidemia, obesidad, endocrinopatías y enfermedades genéticas. (Michalska et al., 2018; Guha et al., 2018). La (IC) se clasifica en base a la fracción de eyección ventricular izquierda (FEVI) y se divide en tres categorías principales. (Redfield y Borlaug en 2023; Groenewegen et al., 2020; Brown et al., 2017). Insuficiencia Cardíaca con Fracción de Eyección Reducida (ICFER). FE es del 40% o menos. Conocida como IC sistólica. Se caracterizada por la incapacidad de los ventrículos para contraerse con fuerza. Puede resultar en hipertrofia excéntrica de los ventrículos y disminución del volumen diastólico debido a resistencia persistente o enfermedad infiltrativa. (Ames et al., 2019). Insuficiencia Cardíaca con Fracción de Eyección Preservada (ICFEp). FE es igual o superior al 50%. Conocida como IC diastólica. Surge de la incapacidad de los ventrículos para relajarse. Puede ser causada por hipertrofia concéntrica debido a daño crónico al miocardio, resultando en una contractilidad ineficaz. Insuficiencia Cardíaca con Fracción de Eyección Media (ICFEm). A veces denominada HFpEF límite o HFpEF mejorada. Se refiere a casos donde la FE en la IC con fracción de eyección reducida supera el 40%. Esta categoría puede presentar características intermedias entre ICFER e ICFEp. (Hansen et al., 2022). La importancia de estas categorizaciones radica en sus correlaciones con datos demográficos de los pacientes, condiciones coexistentes y respuestas al tratamiento, según estudios previos (Bingel et al., 2022; Ambrosetti, 2021). El reconocimiento y la clasificación precisos de la insuficiencia cardíaca son cruciales para determinar el enfoque terapéutico más adecuado para cada caso (Caruso et al., 2016). La mayoría de los tratamientos actuales para la insuficiencia cardíaca suelen tener como objetivo reducir la precarga, aumentar la contractilidad, controlar la frecuencia cardíaca y prevenir la remodelación cardíaca (Sokolska et al., 2019), lo que ha sido posible parcialmente con los avances médicos, la administración de medicamentos y las intervenciones no farmacológicas, disminuyendo la mortalidad y aumentando la expectativa de vida (Fernandez et al., 2020; Barge et al., 2020). Dentro de estas intervenciones, el ejercicio físico se destaca como una intervención crucial en el manejo de la insuficiencia cardíaca, generando beneficios significativos como mejorar la capacidad funcional, reducir los síntomas y mejorar la calidad de vida (Ramsey et al., 2021). Además, el ejercicio físico, dosificado correctamente, provoca un acondicionamiento significativo de las estructuras periféricas, como cambios hemodinámicos que contribuyen a frenar el progreso de la insuficiencia cardíaca (Long et al., 2019). Además del manejo de los factores de riesgo contribuyentes a la insuficiencia cardíaca (López et al., 2022; King et al., 2019). Otras de las modificaciones que el ejercicio físico induce en la insuficiencia cardíaca (IC) incluyen el aumento del gasto cardíaco máximo, volumen de eyección pico y velocidad de llenado diastólico. Asimismo, se observa un retraso en el remodelado del ventrículo izquierdo, mejorando la tolerancia al ejercicio y, por ende, la calidad de vida de los pacientes (Saito et al., 2023; Guazzi et al., 2022; Reddy et al., 2018). La evidencia y las recomendaciones sobre el ejercicio físico en la IC son abundantes (Orozco et al., 2022; Pelliccia et al., 2022). No obstante, la efectividad de las intervenciones depende de diversos factores, como la intensidad, volumen, frecuencia, descansos, edad, nivel de acondicionamiento previo, tipos de ejercicios y su organización, así como la presencia de patologías preexistentes (Lum et al., 2023; Geidl et al., 2020). El control específico de estas variables es particularmente crítico en la (IC), ya que las manifestaciones cardinales, como disnea y fatiga, pueden limitar la capacidad de realizar esfuerzo físico (intolerancia al ejercicio) y desencadenar procesos que conduzcan a la congestión pulmonar y sistémica, así como al aumento de la resistencia vascular periférica (Ezekowitz et al., 2017). Además, es esencial considerar una serie de variables para llevar a cabo intervenciones mediante el ejercicio físico en la IC, como el estadio de la IC, etiología, ICFER o ICFEp, clase funcional, síntomas predominantes, variables de laboratorio (función renal, electrolitos), hallazgos del electrocardiograma y expectativas de sobrevida (NYHA 2009; Sociedad Europea de Cardiología 2019. El ejercicio se ha consolidado como una modalidad terapéutica segura y efectiva para la insuficiencia cardíaca (IC) (Ito S., 2019). Sin embargo, existen diferencias significativas en los protocolos implementados, especialmente en el entrenamiento interválico de alta intensidad (HIIT) (Edwards et al., 2023). Estas diferencias radican en la intensidad del estímulo principal, la intensidad de recuperación (Karatzanos et al., 2020), la frecuencia y duración del periodo de aplicación (Currie et al., 2023), e incluso en las características individuales de los pacientes, como la edad, peso, estatura y composición corporal (Järvinen et al., 2022). Estas variaciones pueden influir en la eficacia del programa de rehabilitación cardíaca.
Dado que existen discrepancias en los protocolos de HIIT, identificar la influencia de variables como la frecuencia, la duración, la intensidad de la recuperación y otras podría ser crucial para optimizar los programas de rehabilitación cardíaca para pacientes con IC. Por lo tanto, el objetivo de esta revisión sistemática es determinar la dosificación óptima del HIIT y su impacto en el Vo2max en pacientes con insuficiencia cardíaca.
Métodos
El diseño de la revisión sistemática siguió el método PRISMA (Preferred Reporting Items for Systematic Reviews) (Page et al., 2021). Se llevó a cabo un proceso de inclusión de artículos y análisis estadístico. Se eliminaron las publicaciones duplicadas y se obtuvo el texto completo de los artículos seleccionados, los cuales fueron evaluados según los criterios de selección establecidos. Las variables relacionadas con el método de entrenamiento, como la frecuencia, la duración total de la sesión, la duración del ejercicio y los intervalos de recuperación, el número total de sesiones, el porcentaje de intensidad de cada intervalo, así como la edad, el sexo y el número de pacientes de cada estudio, fueron extraídas de los artículos y registradas en una hoja de cálculo Excel para su posterior análisis.
Términos y descriptores de búsqueda
Los términos y descriptores de búsqueda utilizados para este estudio se enfocaron en variables clave relacionadas con el entrenamiento de intervalos de alta intensidad (HIIT) y la insuficiencia cardíaca. Se implementaron operadores booleanos como "AND" y "OR" para establecer relaciones precisas entre los términos y asegurar una búsqueda exhaustiva. La estrategia de búsqueda definitiva se estructuró de la siguiente manera:
(High-intensity interval training OR cardiovascular rehabilitation OR physical activity OR physical therapy OR training) AND (heart failure OR cardiovascular disease OR congestive heart failure).
Estos términos se seleccionaron para abarcar diversas facetas del entrenamiento cardiovascular y la insuficiencia cardíaca, asegurando que se capturen estudios relevantes en el ámbito de interés. Además, el protocolo de revisión se registró en PROSPERO antes de iniciar la búsqueda bibliográfica, lo que garantiza la transparencia y la planificación adecuada del proceso de revisión. El número de registro del protocolo de revisión es CRD42023482436. Este enfoque metodológico ayuda a garantizar la rigurosidad y la calidad del proceso de revisión sistemática.
Criterios de inclusión
Ensayos clínicos con asignación aleatoria, estudios de cohortes, estudios observacionales comparativos: retrospectivos o prospectivos. Participantes con diagnóstico de insuficiencia cardíaca aguda o crónica publicados entre enero de 2019 y marzo de 2024, sin restricción de idioma en que se hubiera utilizado un protocolo de EIAI para pacientes con IC que se midiera el VO2max. Dentro de un rango de edad igual o mayor a 55 años. Hombres y mujeres. Intervención a través de un programa de rehabilitación con HIIT. Estudios que comparen el HIIT con otros métodos de ejercicio SID O MICT. O un programa de entrenamiento de la fuerza.
Criterios de exclusión
Estudios no indexados, artículos que no sigan una asignación aleatoria, menores de edad, estudios no concluyentes tras la evaluación del texto completo, los estudios basados en programas de EIAI acuáticos, estudios que no se ajustan al objetivo de la revisión los que incluyeran a pacientes con trasplantes, injertos o valvulopatías y los que estudiaran suplementos alimenticios o ayudas nutricionales o farmacológicas.
Fuentes de información
Se llevó a cabo una revisión sistemática utilizando artículos científicos recopilados de bases de datos indexadas, abarcando el período comprendido entre enero de 2019 y enero de 2024. Las búsquedas se realizaron en 5 bases de datos fundamentales para la investigación médica y científica: PubMed, Scopus, Web of Science, Cochrane Library y Medline.
Proceso de selección de los estudios
El proceso de selección de los estudios se llevó a cabo en varias etapas para garantizar la inclusión de investigaciones pertinentes y la aplicación consistente de los criterios de elegibilidad: Eliminación de Duplicados: Se comenzó por identificar y eliminar estudios duplicados durante la fase de búsqueda. Esto aseguró que cada estudio único se considerara una vez en el proceso de revisión. Selección Inicial por Título y Resumen: Se realizó una selección preliminar basada en el título y el resumen de los estudios. Durante esta fase, se descartaron aquellos estudios que claramente no cumplían con los criterios de elegibilidad o no estaban relacionados con los temas de interés. Revisión Completa: Los estudios que pasaron la fase de selección inicial fueron sometidos a una revisión completa, durante la cual se examinaron detalladamente para asegurar que cumplieran con los criterios de elegibilidad predefinidos. Se verificó la relevancia del contenido y se evaluó si la metodología del estudio se alineaba con los objetivos de la revisión.
Evaluación de la calidad
La calidad metodológica de los estudios incluidos fue evaluada mediante la herramienta Cochrane de riesgo de sesgo (Cochrane ROB) mediante el juicio de sesgo que incluye el sesgo de selección de generación de secuencia aleatoria y ocultamiento de la asignación, sesgo de realización del cegamiento de los participantes y del personal, sesgo de detección de cegamiento de la evaluación de resultados, sesgo de deserción por datos de resultados incompletos, sesgo de informe de informe selectivo y otros sesgos.
Recolección de datos.
Se recopilaron datos sobre los participantes en los estudios, Grupos de intervención y control: Se describieron los grupos que participaron en los estudios, incluyendo detalles sobre las intervenciones que recibieron. Tipología de la patología: Se identificó y describió la patología o condición médica que se abordó en los estudios, en este caso, la insuficiencia cardíaca. Intervención: Se detallaron las intervenciones que se aplicaron en los grupos de estudio, incluyendo información sobre el tipo de ejercicio, la duración y la intensidad. Período y frecuencia de intervención: Se registraron los detalles sobre la duración y la frecuencia de las intervenciones, lo que proporciona información importante sobre la forma en que se administran las terapias. Resultados: Se recopilaron datos sobre los resultados observados principalmente en el Vo2max. U otros parámetros relevantes. Dada la diversidad en los métodos y resultados de los estudios incluidos, se optó por una síntesis narrativa en lugar de un análisis cuantitativo (metaanálisis).
Resultados
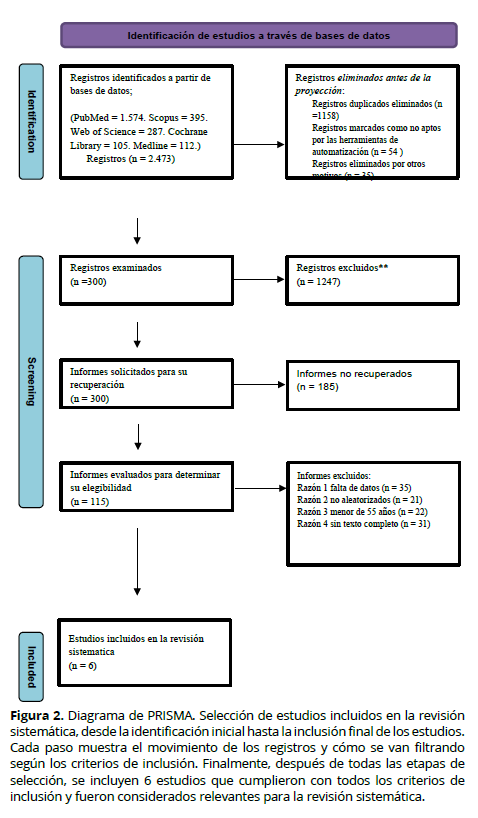
Según nuestros criterios de inclusión, se incluyeron en esta revisión sistemática 6 estudios que usaban el protocolo HIIT y que comparaban HIIT con MICT, SID o algún programa de fuerza en pacientes con IC, que incluían HIIT Y midieron el Vo2max en 5 bases de datos (PubMed, Scopus, Web of Science, Cochrane Library y Medline). Se evaluaron un total de 2,473 registros. Tras la eliminación de duplicados (1,158) y registros marcados como no aptos por herramientas de automatización (54), así como la exclusión por otros motivos (35), se examinaron detenidamente 300 registros. De estos, 1,247 registros fueron excluidos por no cumplir con criterios de inclusión. Se solicitó la recuperación de 300 informes, resultando en la recuperación exitosa de 115 informes. Posteriormente, se evaluaron 115 informes para determinar su elegibilidad, excluyendo 35 por falta de datos, 21 por no ser aleatorizados, 22 por incluir sujetos menores de 55 años y 31 por carecer de texto completo. En la fase final,6 estudios fueron incluidos en la revisión sistemática. La calidad metodológica de los estudios incluidos se evaluó utilizando (Cochrane ROB) específica para revisiones sistemáticas y metaanálisis. La Figura 1, proporciona una visión general de esta evaluación de calidad de evidencia. La Figura 2, proporciona una visión de la estrategia de búsqueda y selección secuencial de los estudios. Los estudios seleccionados, detallados en la Tabla 1, presentan información sobre el objetivo de cada investigación, la clasificación de la enfermedad, la cantidad de participantes del estudio, intervención, duración, frecuencia, los intervalos de trabajo la duración total y la variable para cuantificar la intensidad. La tabla 2 a la 7, presenta los resultados individuales de cada estudio incluyendo información más detallada y relevante, En conjunto, los 6 estudios involucraron a 505 participantes con IC con una fracción de eyección FEVI ≤ 35% A 50%. Específicamente en dos categorías: IC-HFpEF (Insuficiencia Cardíaca con Fracción de Eyección Preservada) e IC-HFrEF (Insuficiencia Cardíaca con Fracción de Eyección Reducida). Se emplean varios métodos de entrenamiento, incluyendo HIIT (Entrenamiento de Intervalos de Alta Intensidad), MICT (Entrenamiento Continuo de Intensidad Moderada), CRT (Entrenamiento de Resistencia de Carga), y MCT (Entrenamiento Continuo de Moderada Intensidad). Las características del entrenamiento abarcan una frecuencia semanal de las sesiones de entrenamiento varía entre 3 y 5 veces. La duración de las sesiones oscila entre 28 y 47 minutos, dependiendo del método de entrenamiento y el estudio.
Figura 2. Diagrama de PRISMA. Selección de estudios incluidos en la revisión sistemática, desde la identificación inicial hasta la inclusión final de los estudios. Cada paso muestra el movimiento de los registros y cómo se van filtrando según los criterios de inclusión. Finalmente, después de todas las etapas de selección, se incluyen 6 estudios que cumplieron con todos los criterios de inclusión y fueron considerados relevantes para la revisión sistemática.
| Estudios | Enfermedad | n | Edad | Método | Veces semana | Tiempo sesión (min) | Intervalo trabajo (min/sg) | Pausa | Duración semanas | Vo2max FCMAX FCR Watts |
|---|---|---|---|---|---|---|---|---|---|---|
| Mueller et al., 2021 | IC. HFpEF. FEVI 50% |
176 | 70 años | HITT | 3 | 38 | 4X4 | 3 | 52 | 80-90% FCR |
| ECM | 5 | 40 | 0 | 0 | 52 | 35-50% FCR |
||||
| Donelli da Silveira et al., 2020 | IC. HFpEF. FEVI 50% |
19 | 60 ± 9 años |
HITT | 3 | 38 | 4 | 3 | 12 | 80-90% VO2max |
| ECM | 3 | 47 | 0 | 0 | 12 | 50-60% VO2max |
||||
| Besnier et al., 2019 | IC. HFpEF FEVI<45% | 31 | 59 ± 13 años | HITT | 5 | 24 | 30 | 30 | 3.5 | 100% Watts |
| MICT | 5 | 30 | 0 | 0 | 3.5 | 60% Watts |
||||
| Turri et al., 2021 | IC. HFpEF/HFrEF FEVI 50% | 23 | 56 ± 10 años | HITT | 3 | 28 | 30x30 | 4 | 36 | 80-100% FCR |
| CRT | 3 | Series 3 | 6 a 12 Repetición | 3 | Circuitos | 50-80% 1Rm |
||||
| Koppen et al., 2021 | IC. HFrEF FEVI ≤ 35% |
215 | 60 ± 11 años | HITT | 3 | 38 | 4 | 3 | 52 | ≥90% Fcmax |
| MCT | 3 | 47 | 0 | 0 | 52 | 60-70 % Fcmax | ||||
| Winzer et al., 2022 | IC. HFpEF FEVI ≤ 50% |
41 | 72 ± 10 años | HITT | 3 | 38 | 4 | 3 | 54 | 90-95% Vo2pico |
| MCT | 5 | 40 | 0 | 0 | 54 | 60-70% Vo2pico |
||||
| Nota; IC; Insuficiencia cardiaca, FEVI; Fracción de eyección del ventrículo izquierdo, HFpEF; Insuficiencia cardiaca con fracción de eyección preservada, HFrEF; Insuficiencia cardiaca con fracción de eyección reducida, HITT; Entrenamiento interválico de alta intensidad, ECM; Entrenamiento continúo moderado, MICT; Entrenamiento continuo de intensidad moderada, CRT; entrenamiento de resistencia en circuitos, VO2max; Consumo máximo de oxígeno, FCR; Frecuencia cardiaca de reposo, 1Rm; una repetición máxima, Fcmax; Frecuencia cardiaca máxima. | ||||||||||
| Autor(es): | Mueller et al., 2021. |
|---|---|
| Diseño del Estudio: | Ensayo clínico aleatorizado multicéntrico, simple ciego. |
| Enfermedad: | IC-HFpEF con FEVI del 50 %, Clase II-III de la New York Heart Association. |
| Características Generales del Estudio: | El objetivo del estudio fue evaluar la eficacia del entrenamiento interválico de alta intensidad (HIIT) y del entrenamiento continúo moderado (MCT) en pacientes con insuficiencia cardíaca. En cicloergómetro. Se conformaron 3 grupos en 5 centros europeos: Berlín, Leipzig, Munich, Amberes y Trondheim. La duración fue de 3 meses en la clínica y 9 meses de entrenamiento en el hogar telemáticamente supervisado. 120 mujeres [67 %]), 166 (92 %) y 154 (86 %) completaron la evaluación a los 3 y 12 meses, Se reportaron suceso adversos. |
Método |
Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (min) | Intervalo de Recuperación | Duración (semanas) | Porcentaje FCR |
|---|---|---|---|---|---|---|---|
| HIIT | 10 MIN. 35% 50% FCR | 3 | 38 | 4X4 | 3 | 52 | 80-90% FCR |
| MCT | 10 MIN. 35% 50% FCR | 5 | 40 | 0 | 0 | 52 | 35-50% FCR |
Características del diseño de entrenamiento.
Método |
Pre base | 3 meses | 12 meses | DIF GRUPOS 3 y 12 MESES | ||
|---|---|---|---|---|---|---|
| HITT | 18,9 /5,4 | 20,2/2,6 | 19,9/6,1 | HIIT/CON 3 1,5 (0,4 a 2,7) |
MCT/CON 3 2,0 (0,9 a 3,1) |
HIIT/MCT 3 0,4 (-1,4 a 0,6) |
| MCT | 18.2/5,1 | 19,8/5,8- | 18,1/5,9 | HIIT/CON 12 1,4 (0,1 a 2,8) |
CON/MCT 12 0,6 (-0,7 a 1,9) |
HIIT/MCT 12 1,8 (0,5 a 2,1) |
| CONTROL | . 19.4/5,6 | 18,9/5,7) | 19.5/5,1 | |||
Resultados en VO2max.
Conclusiones.
Entre los pacientes con HFpEF, los cambios en el VO2 máximo no fueron significativamente diferentes a los 3 o 12 meses entre los asignados al entrenamiento interválico de alta intensidad versus el entrenamiento continúo moderado. Además, ninguno de los grupos cumplió con la diferencia mínima clínicamente importante definida a priori de 2,5 ml/kg/min en comparación con el control de las pautas en ningún momento. |
| Autor(es): | Besnier et al., 2019. |
|---|---|
| Diseño del Estudio: | Estudio prospectivo, mono céntrico, ciego para el evaluador, aleatorizado (1:1) con un diseño de dos grupos paralelos. |
| Enfermedad: | IC. HFpEF FEVI<45% Clase II-III de la New York Heart Association. |
| CaracterÃsticas Generales del Estudio: | El objetivo fue verificar Comparar la eficacia del entrenamiento en intervalos de alta intensidad (HIIT) con el entrenamiento continuo de intensidad moderada (MICT) en la mejora de la variabilidad de la frecuencia cardÃaca (VFC), la aptitud cardiorrespiratoria y la función cardÃaca en pacientes con (IC). en ciclo ergómetro. Diseño del Estudio: 31 pacientes con insuficiencia cardÃaca crónica (FEVI < 45%) fueron asignados aleatoriamente a MICT (n = 15) o HIIT (n = 16) en un programa de rehabilitación breve (media de 27 dÃas). Se realizaron electrocardiografÃa de 24 horas, ecocardiografÃa y prueba de ejercicio cardiopulmonar al inicio y al final del programa. Procedimientos Adicionales: Se incluyeron sesiones de trabajo de fuerza con el propio peso corporal cinco dÃas a la semana. |
Método |
Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (min) | Intervalo de Recuperación | Duración (semanas) | Porcentaje Vo2max |
|---|---|---|---|---|---|---|---|
| HIIT | 10 MIN. 10% 50% Vo2max | 3 | 38 | 4 | 3 | 12 | 80-90% vo2max |
| MCT | 10 MIN. 35% 50% Vo2max | 3 | 47 | 0 | 0 | 12 | 50-60% Vo2max |
Características del diseño de entrenamiento.
Método |
Pre base | Post 12 semanas | Dif dentro G | P-value | DIF Grupos | IC 95% | P-value |
|---|---|---|---|---|---|---|---|
| HITT | (16,1/3,3) | (19,6/3,5) | 3,5 (3,1 a 4,0) | P<0,001 | HIIT/MCT | 1,6 (-2,6-3,5) | P<0,001 |
| MCT. | (17,6/3,5) | (19,5/3,7) | 1,9 (1,2 a 2,5) | P<0,001 |
Resultados en VO2max.
Conclusiones.
Este ensayo clínico aleatorizado proporcionó evidencia de que el entrenamiento en intervalos de alta intensidad es una modalidad de ejercicio potencial para pacientes con HFpEF, siendo más eficaz que el entrenamiento continuo moderado para mejorar el VO 2 máximo |
| Autor(es): | Besnier et al., 2019. |
|---|---|
| Diseño del Estudio: | Estudio prospectivo, mono céntrico, ciego para el evaluador, aleatorizado (1:1) con un diseño de dos grupos paralelos. |
| Enfermedad: | IC. HFpEF FEVI<45% Clase II-III de la New York Heart Association. |
| Características Generales del Estudio: | El objetivo fue verificar Comparar la eficacia del entrenamiento en intervalos de alta intensidad (HIIT) con el entrenamiento continuo de intensidad moderada (MICT) en la mejora de la variabilidad de la frecuencia cardíaca (VFC), la aptitud cardiorrespiratoria y la función cardíaca en pacientes con (IC). en ciclo ergómetro. Diseño del Estudio: 31 pacientes con insuficiencia cardíaca crónica (FEVI < 45%) fueron asignados aleatoriamente a MICT (n = 15) o HIIT (n = 16) en un programa de rehabilitación breve (media de 27 días). Se realizaron electrocardiografía de 24 horas, ecocardiografía y prueba de ejercicio cardiopulmonar al inicio y al final del programa. Procedimientos Adicionales: Se incluyeron sesiones de trabajo de fuerza con el propio peso corporal cinco días a la semana. |
Método |
Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (min) | Intervalo de Recuperación | Duración (semanas) | Porcentaje Watts |
|---|---|---|---|---|---|---|---|
| HIIT | 50% Watts | 5 | 2X8X4 | 30 | 30 | 3.5 | 100% Watts |
| MCT | 40% Watts | 5 | 30 | 0 | 0 | 3.5 | 60% Watts |
Características del diseño de entrenamiento.
Método |
Pre base | Post 3,5 semanas | Dif dentro G | P-value | DIF Grupos | IC 95% | P-value |
|---|---|---|---|---|---|---|---|
| HITT | 17,2/4,5 | 20,2/5,8 | 3,0 (2,1 a 4,0) | P<0,001 | HIIT/MCT | 2,3 (-2,6-3,5) | P<0,001 |
| MCT. | 15,0/4,6 | 15,7/5,1 | 0,7 (0,1 a 2,2) | P<0,001 |
Resultados en VO2max.
Conclusiones.
| En este breve programa de rehabilitación, el HIIT fue significativamente superior al programa MICT clásico para mejorar el tono parasimpático y el consumo máximo de oxígeno. |
| Autor(es): | Turri et al., 2021. |
|---|---|
| Diseño del Estudio: | Ensayo controlado aleatorio multicéntrico. |
| Enfermedad: | IC. ICFER y ICFEp FEVI del 50 %. |
| Características Generales del Estudio: | El objetivo fue evaluar los efectos de dos modalidades de entrenamiento de alta intensidad, (HIIT) y el entrenamiento progresivo de alta resistencia en circuitos (CRT), en pacientes con (IC). En tredmil. Se asignaron aleatoriamente a tres grupos: HIIT, CRT y control (CG) en proporción 1:1:1. Las evaluaciones se realizaron al inicio y después de 36 sesiones de entrenamiento. Se incluyeron períodos de familiarización con el entrenamiento para adaptación del paciente (6 a 10 sesiones). La intensidad se basó en la watts. |
Método |
Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (min) | Intervalo de Recuperación | Duración (semanas) | Porcentaje FCR |
|---|---|---|---|---|---|---|---|
| HIIT | 50% FCr | 3 | 28 | 4 | 3 | 36 | 100% Watts |
| CRT | 40% FCr | 3 | Series 3 | Rep.6 a 12 | N circuitos 3 | Descanso 1min | 50-80 1Rm |
Resultados en el Vo2max. Mean (SD)/Difference (95% CI.
Método |
Pre base | Post 8 meses | Dif dentro G | P-value | DIF grupos | IC 95% | P-value |
|---|---|---|---|---|---|---|---|
| HITT | (17,5/4,2) | (19,6/4,9) | 2,1 ± 6,5. | P<0,001 | HIIT vs. CRT | 0,1 (-5,5-5,2) | P<0,548 |
| CRT | (16,9/2,5) | (19,9/3,4) | 3,0 ± 4,2 | P<0,001 | HIIT vs. GC | 1,6 (-3,4-6,5) | P<0,001 |
| CONTROL | . (20,2/3,3) | (20,1/4,2) | - 0,1 ± 5,3. | P<0,532 | CRT vs GC | 1,7 (-3,6-7,1) | P<0,001 |
Conclusiones.
Este estudio preliminar tiende a indicar por primera vez que el entrenamiento en intervalos de alta intensidad promueve un efecto superior en comparación con el entrenamiento progresivo de resistencia en circuito de alta intensidad al mejorar la aptitud cardiorrespiratoria, la fuerza muscular y el rendimiento físico. |
| Autor(es): | Koppen et al., 2021. |
|---|---|
| Diseño del Estudio: | El estudio clínico multicéntrico aleatorizado. |
| Enfermedad: | IC. HFrEF. FEVI del ≤ 35%) Clase II-III de la New York Heart Association. |
| Características Generales del Estudio: | El estudio busca determinar el efecto de una intervención de entrenamiento de resistencia de 12 semanas, y 52 semanas de seguimiento con diferentes intensidades, en pacientes estables con (HFrEF ≤ 35%). Además, se analizarán las asociaciones entre los niveles de hs-cTnT y el Consumo Máximo de Oxígeno (VO2pico). La intensidad del entrenamiento se basa en la frecuencia cardíaca máxima (FCmax). se utilizó tredmil. Se logró un cumplimiento del 93.3% en el número de sesiones supervisadas. Las evaluaciones al inicio del estudio, después del programa de 12 semanas y al año de seguimiento. Los niveles de intensidad se determinarán en función del VO2pico, la FCmax y la escala de Borg para la percepción del esfuerzo respiratorio. |
Método |
Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (min) | Intervalo de Recuperación | Duración (semanas) | Porcentaje FCmax |
|---|---|---|---|---|---|---|---|
| HIIT | 10 min 60-70 % Fcmax |
3 | 38 | 4 | 3 | 52 | ≥90% FCmax |
| MCT | 10 min 60-70 % Fcmax |
3 | 47 | 4 | 0 | 52 | 60- 70% FCmax |
Características del diseño de entrenamiento.
Método |
Pre base | 12 semanas | Semana 52 | PRE/12 | PRE/52 | DIF GRUPOS 12 | DIF GRUPOS 52 |
|---|---|---|---|---|---|---|---|
| HITT | 16,8 (15,8 a 17,8) | 18,2 (16,3 a 20,0) | 17,1 (15,5 a 18,6) | 0,9 (0,0 a 1,4) | 0,1 (-0,4 a 1,0) | HIIT/MCT -0,4 (-1,7 a 0,8) |
HIIT/MCT 0,1 (-1,8 a 2,0) |
| MCT | 16,2 (15,3 a 18,7) | 17,0 (15,7 a 19,6) | 16,4 (15,0 a 18,6) | 1,1 (0,5 a 1,7) | 1,2 (-0,2 a 1,4) | HIIT/CON 1,4 (0,2 a 2,6) |
HIIT/CON -0,3 (-2,3 a 1,6) |
| CONTROL | 18,4 (16,8 a 19,6) | 17,4 (15,7 a 19,8) | 18,2 (15,8 a 20,0) | -0,1 (-0,9 a 0,4) | -0,4 (-1,3 a 0,4) | MCT/CON 1,8 (0,5 a 3,0) |
MCT/CON -0,4 (-2,3 a 1,5) |
Resultados en VO2max.
Conclusiones.
En pacientes con HFrEF estable, una intervención se asoció con una reducción de hs-cTnT en todos los grupos cuando se ajustó por variables clínicas. Un mayor VO 2 pico se correlacionó con una menor hsâ?ÂÂcTnT, lo que sugiere un efecto positivo a largo plazo del aumento del VO 2 pico sobre la lesión miocárdica subclínica en la insuficiencia cardíaca con fracción de eyección, independientemente del programa de entrenamiento. |
| Autor(es): | Winzer et al., 2020. |
|---|---|
| Diseño del Estudio: | Ensayo clínico aleatorizado, simple ciego. |
| Enfermedad: | IC. HFpEF. (FEVI) ≤50%. |
| Características Generales del Estudio: | El objetivo del presente estudio fue analizar los cambios moleculares en el músculo esquelético de pacientes con insuficiencia cardíaca con fracción de eyección preservada que realizaron diferentes modalidades de ET. (HIIT Y MCT). Se cuantificaron la expresión de proteínas y ARNm de proteínas relacionadas con la atrofia, las actividades enzimáticas de las enzimas vinculadas al metabolismo energético y las células satélite (SC). Y Vo2max, la intensidad se midió a través del vo2pico a través de un cicloergómetro. |
Los protocolos de entrenamiento, como el número de repeticiones, series, y la intensidad del ejercicio, también varían significativamente entre los estudios. La duración total de los programas de entrenamiento varía desde 12 hasta 54 semanas, lo que sugiere una amplia gama de enfoques en términos de duración y seguimiento. Se utilizan diversos parámetros para evaluar la eficacia del entrenamiento, como el VO2max, FCR (Frecuencia Cardíaca de Reserva), Watts, 1RM (Repetición Máxima), y Vo2pico (Consumo Máximo de Oxígeno). La edad media de los participantes varía entre 56 y 72 años, con un rango de desviación estándar ±9 que indica variabilidad en la edad de la población estudiada. El tamaño de la muestra varía significativamente entre los estudios, desde 19 hasta 215 participantes. En conjunto, estos hallazgos sugieren una diversidad de enfoques en el diseño y la implementación de programas de entrenamiento físico para pacientes con insuficiencia cardíaca, lo que refleja la complejidad y la variedad de necesidades en esta población. Los resultados de estos estudios pueden proporcionar información valiosa sobre los beneficios y la eficacia del ejercicio físico en pacientes con insuficiencia cardíaca, y pueden ayudar a informar futuras intervenciones y recomendaciones clínicas.
Riesgo de sesgo (Figura 1)
En el contexto de la revisión de seis estudios que investigaron el impacto del Entrenamiento de Intervalos de Alta Intensidad (HIIT) en pacientes diagnosticados con insuficiencia cardíaca (IC), se han observado tendencias significativas en cuanto al riesgo de sesgo asociado con diferentes aspectos de los estudios. Los análisis revelaron que todos los estudios presentaban un bajo riesgo de sesgo en lo referente a la generación de secuencia aleatoria y la ocultación de la asignación. Estos hallazgos sugieren que los métodos utilizados para asignar a los participantes en los diferentes grupos de intervención fueron generalmente transparentes y bien documentados. Por otro lado, se detectó un riesgo medio a alto en lo concerniente al enmascaramiento de los participantes y el personal, así como en la evaluación del resultado, particularmente en los estudios realizados por Besnier et al., 2019; Turri et al., 2021; Koppen et al., 2021; Winzer et al., 2020. Esto implica que podría existir una posibilidad de sesgo debido a la falta de cegamiento adecuado tanto de los participantes como del personal involucrado en la intervención, así como en la evaluación de los resultados obtenidos. Además, los datos relacionados con resultados incompletos, notificación selectiva y otros posibles sesgos se identificaron generalmente como bajos en todos los estudios examinados. Esto sugiere que los estudios en su mayoría proporcionaron datos completos y transparentes, minimizando la posibilidad de sesgos relacionados con la omisión selectiva de datos o la presencia de otros factores de sesgo no especificados. En resumen, aunque la generación de secuencia aleatoria y la ocultación de la asignación fueron aspectos metodológicos bien manejados en todos los estudios, se debe prestar especial atención al enmascaramiento y la evaluación de los resultados para garantizar la fiabilidad y validez de las conclusiones extraídas de estos estudios.
Diagrama de flujo PRISMA 2020 (Figura 2), (Table 1)
Los datos generales en la Tabla 1, describen la diversidad de enfoques en el diseño y la implementación de programas de entrenamiento físico para pacientes con insuficiencia cardíaca resalta la necesidad de considerar diferentes estrategias para abordar las necesidades individuales de los pacientes y optimizar los resultados del tratamiento. Los resultados de estos estudios ofrecen información valiosa sobre los beneficios y la eficacia del ejercicio físico en pacientes con insuficiencia cardíaca, lo que puede influir en futuras intervenciones y recomendaciones clínicas. Por lo tanto, estos estudios proporcionan evidencia que respalda la inclusión del ejercicio físico como parte integral del manejo de la insuficiencia cardíaca. Las recomendaciones clínicas pueden beneficiarse de la comprensión de los diferentes enfoques de entrenamiento y sus impactos específicos en la salud cardiovascular de los pacientes.
Descripción de los estudios (Table 2-7)
Discusión
Los beneficios del ejercicio sobre el sistema cardiovascular están bien establecidos y la actividad física regular es un componente importante para minimizar el riesgo de varias enfermedades. Sin embargo, la participación en ejercicio intensivo puede aumentar el riesgo de arritmias fatales en personas predispuestas.
El propósito fundamental de esta revisión sistemática es evaluar la dosificación óptima del entrenamiento interválico de alta intensidad (HIIT) en la rehabilitación cardíaca y su impacto en el VO2max. Los principales resultados sugieren que el HIIT es más efectivo que otros métodos de entrenamiento para mejorar el VO2max, y ofrece flexibilidad en términos de intensidad, frecuencia, duración e intervalos de trabajo. Esta efectividad se mantiene independientemente de los fenotipos y etiologías específicas de la insuficiencia cardíaca evaluada. Además, las mejoras en cuanto al VO2max es el obtenido entre las semanas 3 y 12 en ambas enfermedades. Diferentes estudios han demostrado los beneficios del ejercicio físico en la insuficiencia cardíaca (Nunnari y Suomalainen, 2012; Huertas et al., 2019; López et al., 2022), consolidando su papel como herramienta de diagnóstico y pronóstico, así como de intervención terapéutica en la insuficiencia cardíaca crónica (Cattadori et al., 2018). King et al. (2019) explican que el conocimiento, la aplicación clínica y el interés de la investigación sobre las interacciones mutuas entre el ejercicio y la insuficiencia cardíaca abarca distintas fases de la progresión de la enfermedad: Antes del inicio de la insuficiencia cardíaca (prevención primaria): el ejercicio proporciona un beneficio protector en la prevención de la insuficiencia cardíaca. (Martland et al., 2020). Con insuficiencia cardíaca presente (prevención secundaria): la mejora en la capacidad de ejercicio mediante el entrenamiento aporta beneficios significativos. Predicción del futuro en pacientes con insuficiencia cardíaca: la alteración en la capacidad de ejercicio, como característica principal de la insuficiencia cardíaca, se utiliza como factor pronóstico. Estas conclusiones están respaldadas por un nivel de evidencia A y una recomendación de clase 1, de acuerdo con las guías actuales de la European Society of Cardiology (2023). Este cuerpo de evidencia destaca la importancia del ejercicio en el manejo integral de la insuficiencia cardíaca y su potencial para mejorar la calidad de vida y los resultados clínicos de los pacientes. (Kristiansen et al., 2022).
Actualmente existen diferentes modalidades de ejercicio de resistencias, en todos ellos principalmente en el HIIT, la dosificación especifica principalmente la intensidad, volumen y frecuencia que puedan inducir adaptaciones fisiológicas son bastantes críticas. (Pelliccia et al., 2019; Singam et al., 2020; Kourek et al., 2020). Ya que cada subtipo de IC presenta características clínicas distintas y puede responder de manera diferente a los estímulos del entrenamiento. (Habeeb et al., 2023). Por lo tanto según Lum et al., (2023) Y Geidl et al., (2020). El control específico de estas variables es particularmente crítico en la (IC), ya que las manifestaciones cardinales, como disnea y fatiga, pueden limitar la capacidad de realizar esfuerzo físico (intolerancia al ejercicio) y desencadenar procesos que conduzcan a la congestión pulmonar y sistémica, así como al aumento de la resistencia vascular periférica (Ezekowitz et al., 2017). Además, la dosificación óptima del HIIT, incluida la intensidad, la duración y la frecuencia del ejercicio, sigue siendo un área de investigación activa y debate según Zhu, X., et al., (2023) y Tzanis et al., (2017). En consecuencia, la implementación exitosa del ejercicio en pacientes con IC requiere consideraciones específicas, como la individualización de los programas de entrenamiento en función del estado clínico y la capacidad funcional de cada paciente. (Stamatakis et al., 2022).
Tal como se describe en los estudios incluidos en esta revisión, los efectos de la dosificación y su efecto en el vo2max, son dependientes principalmente del método de entrenamiento y sus características. Considerando el modo de ejercicio, Tres de los 6 estudios incluidos en la revisión, Mueller et al., 2021: Winzer et al., 2020: Besnier et al., 2019, utilizaron el Cicloergómetro como modo de ejercicio. Los estudios de Turri et al., 2021: Koppen et al., 2021: Anderson et al., 2016, emplearon la cinta de correr (treadmill) como modo de ejercicio. La respuesta específica del vo2max está condicionada a forma de trabajo, ya que el cicloergómetro y la cinta de correr imponen diferentes demandas biomecánicas y metabólicas en el cuerpo. (Hanson et al., 2016). El cicloergómetro inicialmente puede no generar un estrés metabólico significativo, pero a intensidades más altas pueden acelerar las respuestas cardiacas, metabólicas y ventilatorias. La cinta de correr impone una carga más generalizada al sistema muscular y puede provocar respuestas más exageradas en el sistema cardiovascular y respiratorio ante el aumento de la intensidad. (Gerlach et al., 2018). Ambos grupos, tanto el que utilizó cicloergómetro como el que usó cinta de correr, experimentaron mejoras en el VO2max después del programa de entrenamiento. Sin embargo, en uno de los estudios (Mueller et al., 2021) no se observaron diferencias significativas entre las modalidades de ejercicio en cuanto a los resultados.
En relación a la duración de las sesiones.
En los estudios que utilizaron cicloergómetro Mueller et al., 2021. El estudio realizó sesiones de ejercicio 3 veces por semana con una duración de 38 minutos, y también 5 veces por semana con 40 minutos de duración. No se observaron diferencias significativas en el VO2max entre los grupos de intervención y control después de 3 y 12 meses. Besnier et al., 2019. El estudio realizó sesiones de ejercicio 5 veces por semana, con una duración de 24 minutos para el grupo de HIIT y 30 minutos para el grupo de MCT. El grupo HIIT experimentó un aumento significativamente mayor en el VO2max en comparación con el grupo MCT. Winzer et al., 2020. Las sesiones de ejercicio se llevaron a cabo 3 veces por semana, con una duración de 38 minutos para el grupo de HIIT y 40 minutos para el grupo de MCT. Se observaron mejoras en el VO2max en todos los grupos, pero los marcadores moleculares indicaron una reducción en la atrofia muscular con HIIT después de 3 meses,aunque estos efectos no se mantuvieron después de 12 meses. Los estudio que utilizaron tredmil. Anderson et al., 2016. Las sesiones de ejercicio se llevaron a cabo 3 veces por semana, con una duración de 38 minutos para el grupo de HIIT y 37 minutos para el grupo de MCT. Ambos grupos mostraron aumentos significativos en el VO2max, con un incremento mayor en el grupo HIIT. Turri et al., 2021. Las sesiones de ejercicio se llevaron a cabo 3 veces por semana, con una duración de 28 minutos para el grupo de HIIT y con sesiones de circuito para el grupo de CRT. Ambos grupos mostraron aumentos en el VO2max, sin diferencias significativas entre ellos. Koppen et al., 2021. El estudio realizó sesiones de ejercicio 3 veces por semana, con una duración de 38 minutos para el grupo de HIIT y 47 minutos para el grupo de MCT. Ambos grupos experimentaron mejoras en el VO2max después del programa de entrenamiento, pero no se observaron diferencias significativas entre ellos. Es importante considera en este sentido la frecuencia del entrenamiento para tener una relación coherente con los efectos del entrenamiento. (Heidenreich et al., 2022). La variabilidad en la duración de las sesiones no solo refleja la adaptabilidad del HIIT, sino también la necesidad de considerar la diversidad de enfoques temporales para maximizar los beneficios asociados al Vo2max. La atención a estas diferencias temporales, respaldada por las investigaciones de Martland et al. (2020), emerge como un aspecto clave en la aplicación práctica del HIIT en la rehabilitación cardíaca. En el estudio de O’Connor et al., 2009, con una muestra de 2300 en pacientes con insuficiencia cardíaca con fracción de eyección reducida (ICFEr). Se prescribió con una frecuencia de 3 sesiones semanales hasta completar un total de 36, con un volumen de ejercicio promedio de 30 minutos por sesión, Se establece que a mayores volúmenes de ejercicio disminuye el número de internamientos y mortalidad por causas cardiovasculares en un 15%, estableciendo una relación dosis respuesta y el volumen de ejercicio como un factor predictor.
En relación a la frecuencia por semana.
Tanto los estudios que utilizaron el cicloergómetro como los que emplearon la cinta de correr demostraron cumplir o superar las recomendaciones del Colegio Americano de Medicina del Deporte (2022). Cicloergómetro: Mueller et al., 2021: HIIT (3 veces por semana) y MCT (5 veces por semana). Winzer et al., 2020: HIIT (3 veces por semana) y MCT (5 veces por semana). Besnier et al., 2019: HIIT (5 veces por semana) y MCT (5 veces por semana). Cinta de correr: Anderson et al., 2016: HIIT (3 veces por semana) y MCT (3 veces por semana). Turri et al., 2021: HIIT (3 veces por semana) y CRT (3 veces por semana). Koppen et al., 2021: HIIT (3 veces por semana) y MCT (3 veces por semana). En general, un nivel más alto de actividad física (frecuencia, duración o volumen) está asociado con mayores beneficios según Departamento de Salud y Servicios Humanos de EE. UU (2018). Es crucial considerar otros factores como la intensidad, duración y tipo de ejercicio, ya que estos elementos también influyen en la respuesta fisiológica y los resultados del VO2max. (Blond et al., 2020). En general los estudios reportan una frecuencia de trabajo de 3 días a la semana, esta información resulta intrigante, ya que sugiere una consistencia en la programación que podría ser crucial para desencadenar adaptaciones efectivas.
El establecimiento de un patrón de estimulación regular se revela como un factor clave, ya que el efecto residual del estímulo podría perder eficacia con interrupciones frecuentes. En este sentido, la necesidad de mantener una continuidad en el tiempo se alinea con el concepto de generar procesos de supercompensación. (Anderson et al., 2016). La elección unánime de una frecuencia de 3 días a la semana entre los estudios indica un consenso aparente en la literatura revisada. Este consenso respalda la noción de que la regularidad en la aplicación del HIIT es esencial para inducir adaptaciones fisiológicas significativas. La consideración de Sultana et al., (2019). Acerca de la supercompensación destaca la importancia de mantener un patrón de estímulo continuo para optimizar los efectos del entrenamiento. En consecuencia, la consistencia en la frecuencia de trabajo podría considerarse como una práctica recomendada en la implementación de programas de HIIT en la rehabilitación cardíaca. Este enfoque puede contribuir a maximizar los beneficios y garantizar una respuesta fisiológica adecuada, proporcionando una base para futuras investigaciones y pautas clínicas en el ámbito del HIIT y la rehabilitación cardíaca.
En relación al intervalo de trabajo.
Cicloergometro: Mueller et al., 2021 HIIT. Intervalo de Trabajo (min) 4X4. Intervalo de Recuperación 3 min. MCT. Duración de Sesiones (min) 40. Besnier et al., 2019: HIIT. Intervalo de Trabajo (seg) 30. Intervalo de Recuperación 30 seg. MCT: Duración de Sesiones (min) 30. Winzer et al., 2022: HIIT. Intervalo de Trabajo (min) 4. Intervalo de Recuperación 3 min. MCT: Duración de Sesiones (min) 40. Tredmill: Anderson et al., 2016: HIIT. Intervalo de Trabajo (min) 4X4 Intervalo de Recuperación 3 min. MCT Duración de Sesiones (min) 37. Turri et al., 2021: HIIT. Intervalo de Trabajo (min) 3 Intervalo de Recuperación 4 min totalizando 4 ciclos de 7 minutos. CRT: Repeticiones de 6 0 12 circuitos 3 intervalo de recuperación 4 min. Numero de ejercicios 6. Koppen et al., 2021. Intervalo de trabajo: 4 minutos. Pausa: 3 minutos. MCT: Duración 47 min. Los resultados de los estudios mencionados, que utilizan diferentes protocolos de intervalos de alta intensidad (HIIT) en cicloergómetro y cinta de correr, pueden proporcionar una comprensión general de los efectos del ejercicio de intervalos de alta intensidad en la salud y el rendimiento físico. Sin embargo, es esencial tener en cuenta la variabilidad individual, como señala Gíbala (2021). La diversidad en los enfoques de intervalos observados en estos estudios destaca la falta de un enfoque único y señala la necesidad de considerar la adaptabilidad del HIIT a diferentes perfiles de pacientes. La evidencia de beneficios asociados al Vo2max, a pesar de estas divergencias en los intervalos de trabajo, resalta la eficacia de esta modalidad de entrenamiento en el contexto de la rehabilitación cardíaca. La observación de Quindry et al., (2019) sobre la individualidad refuerza la idea de que no existe un enfoque único que se ajuste a todos. La variabilidad en los intervalos puede ser clave para atender las necesidades específicas y las capacidades individuales de los pacientes, optimizando así los resultados del HIIT en la mejora del Vo2max. Esta flexibilidad en la programación del HIIT permite una personalización que puede ser esencial para maximizar los beneficios en el ámbito de la rehabilitación cardíaca.
En relación a la intensidad de la recuperación.
La mayoría de los estudios informaron que las recuperaciones activas, situadas entre el 40% y el 60% de la Fcmax, no producen adaptaciones significativas en el VO2max. Este resultado podría deberse a que una recuperación activa a una mayor intensidad facilite la optimización de la resina de fosfocreatina, una mayor oxidación del lactato y una mejora en la gluconeogénesis del lactato (Brooks et al., 2021). Sin embargo, a pesar de que algunos autores han recomendado la recuperación pasiva (Desgorces et al., 2023), se encontró que esta no fue tan eficaz como la recuperación activa (Thurlow et al., 2023). La preferencia por la recuperación activa sobre la pasiva, respaldada por la mayoría de los estudios revisados, sugiere que una mayor intensidad durante la recuperación puede desempeñar un papel crucial en la optimización de varios procesos fisiológicos clave. El énfasis en la resíntesis de fosfocreatina, la oxidación del lactato y la gluconeogénesis del lactato destaca cómo la intensidad de la recuperación puede influir en estos procesos, contribuyendo así a los beneficios generales del HIIT en la rehabilitación cardíaca. La discrepancia entre las recomendaciones de recuperación activa y pasiva subraya la complejidad de este aspecto y la necesidad de abordar la variabilidad en la respuesta individual. La elección entre recuperación activa y pasiva podría depender de diversos factores, incluidas las características individuales de los pacientes y sus metas de rehabilitación cardíaca de la recuperación, para maximizar los beneficios en la salud cardiovascular.
En relación a la duración de las sesiones.
Cicloergometro: Mueller et al., 2021. 52. Semanas. Besnier et al., 2019. 3.5 semanas. Winzer et al., 2022. 54 semanas. Tredmil: Anderson et al., 2016. 12 semanas. Turri et al., 2021. 36 Koppen et al., 2021. 52. Semanas. La variabilidad en las duraciones de los estudios destaca la diversidad en los enfoques de los programas de entrenamiento de intervalos de alta intensidad (HIIT) y subraya la importancia de comprender cómo la duración del programa puede influir en los resultados del ejercicio. En cada uno de estos casos, se logró el efecto esperado en el Vo2max. Este patrón refleja la importancia crítica del factor tiempo como elemento clave a considerar en el volumen total de la sesión de entrenamiento. Sin embargo, es interesante destacar que, a pesar de esta evidencia, el HIIT se caracteriza por su capacidad de inducir respuestas significativas con tiempos mínimos de estímulo, como sugieren Ellingsen et al., (2017). La variabilidad en la duración de las sesiones, junto con el logro de resultados efectivos en todos los casos, resalta la flexibilidad inherente al HIIT. Esta adaptabilidad sugiere que, aunque el tiempo de sesión puede ser un componente crucial, existe margen para ajustes según las necesidades y capacidades individuales de los participantes. La discrepancia entre la duración típica del HIIT y la variabilidad observada en estos estudios plantea interrogantes interesantes sobre la relación entre el tiempo de estímulo y la eficacia del entrenamiento. La observación de Yin et al., (2023) sobre el tiempo mínimo como estímulo principal sugiere la necesidad de investigaciones adicionales para comprender mejor cómo optimizar la duración de las sesiones de HIIT en la rehabilitación cardíaca, considerando la diversidad de respuestas individuales y la eficacia del entrenamiento en diferentes contextos.
En relación a la intensidad del entrenamiento.
Todos los estudios revisados informaron una intensidad media del 85% de trabajo efectivo. Este dato sugiere que este factor puede ser el elemento clave que, por sí solo, determina los efectos del HIIT sobre el Vo2max. Sin embargo, Casado et al., (2023) señalan que diversas intensidades de entrenamiento, desde sesiones prolongadas y continuas en el dominio moderado hasta sesiones repetidas de intervalos de sprint, pueden mejorar el rendimiento de resistencia. Esto es siempre y cuando el entrenamiento esté equilibrado dentro de un programa más amplio y específico para las demandas fisiológicas del paciente. La consistencia en la intensidad del 85% de trabajo efectivo entre los estudios sugiere que este nivel de esfuerzo es un denominador común para lograr mejoras en el Vo2max mediante el HIIT. Sin embargo, la observación de Angadi et al., (2015) plantean la noción de que una variedad de intensidades podría ser eficaz, siempre que estén integradas adecuadamente en un programa de entrenamiento más amplio y específico. Este contraste destaca la complejidad de la relación entre la intensidad del entrenamiento y los efectos sobre el Vo2max. La consideración de diversas intensidades puede ser clave para adaptarse a las necesidades individuales de los pacientes y para optimizar los beneficios del HIIT en la rehabilitación cardíaca. Este enfoque más amplio hacia la intensidad podría abrir oportunidades para diseñar programas más personalizados y efectivos, considerando las variaciones en la tolerancia individual y las demandas fisiológicas específicas.
En relación a la edad integrantes.
Los resultados revelaron que no hubo diferencias significativas entre los subgrupos de pacientes. Este hallazgo sugiere que la edad no parece influir de manera significativa en las mejoras del VO2máx, a pesar de investigaciones previas que aseguran que la edad puede ser un factor determinante en la aparición de insuficiencia cardíaca (IC), debido a las enfermedades asociadas con el envejecimiento (Mahatme et al., 2022). La falta de diferencias significativas en los subgrupos de edad dentro de los estudios de HIIT para la rehabilitación cardíaca sugiere que esta modalidad de entrenamiento puede ser igualmente beneficiosa independientemente de la edad de los participantes.
Este resultado contradice las expectativas basadas en investigaciones anteriores que vinculan la edad con un mayor riesgo de enfermedades cardiovasculares. (Cuende 2016). La discrepancia entre los hallazgos actuales y las afirmaciones previas subraya la necesidad de continuar con investigaciones específicas en el contexto del HIIT y la rehabilitación cardíaca. Es posible que la intensidad y la adaptabilidad del HIIT permitan mejoras significativas en el VO2máx independientemente de la edad, lo que tiene implicaciones importantes para la inclusión de pacientes de diferentes grupos etarios en programas de rehabilitación cardíaca basados en HIIT.
Conclusiones
Las conclusiones extraídas de la revisión detallada de los estudios sobre entrenamiento de intervalos de alta intensidad (HIIT) en la rehabilitación cardíaca son las siguientes: Efectividad del HIIT: Los resultados revelan consistentemente que el HIIT es efectivo para mejorar el consumo máximo de oxígeno (VO2max) y otros marcadores de salud cardiovascular en pacientes con diversas condiciones cardíacas. Esto destaca la capacidad del HIIT para ser una estrategia valiosa en programas de rehabilitación cardíaca. Modo de Ejercicio: Se observa que tanto el cicloergómetro como la cinta de correr son modos efectivos de ejercicio en programas de HIIT. Aunque hay diferencias biomecánicas, ambas modalidades demostraron generar mejoras en el VO2max, resaltando la versatilidad del HIIT en la elección del modo de ejercicio. Duración y Frecuencia: La variabilidad en la duración de las sesiones sugiere que el HIIT puede ser adaptable a diferentes programas, y resultados efectivos se lograron con sesiones que varían entre 24 y 47 minutos. La frecuencia de tres sesiones por semana parece ser un consenso eficaz entre los estudios revisados. Intervalos de Trabajo y Recuperación: Aunque existen diferencias en los protocolos de intervalos de alta intensidad, todos los estudios demuestran mejoras en el VO2max. La variabilidad en los intervalos de trabajo sugiere que hay margen para ajustar el HIIT según las necesidades y capacidades individuales de los participantes. Intensidad: La consistencia en el uso de una intensidad media del 85% de trabajo efectivo entre los estudios destaca este nivel de esfuerzo como comúnmente eficaz para lograr mejoras en el VO2max. La consideración de diversas intensidades puede ser clave para adaptarse a las necesidades individuales de los pacientes. Edad: La falta de diferencias significativas en los resultados entre subgrupos de edad sugiere que el HIIT puede ser beneficioso independientemente de la edad de los participantes. Esto contradice las expectativas previas y resalta la capacidad del HIIT para ser inclusivo en programas de rehabilitación cardíaca. En conjunto, la revisión respalda el HIIT como una estrategia versátil y eficaz en la rehabilitación cardíaca, brindando beneficios significativos en el VO2max y otros indicadores de salud cardiovascular.
Aplicación Práctica
Los resultados de este estudio indican que el entrenamiento HIIT afecta positivamente al VO2máx de los pacientes con IC o con EAC y aporta ventajas superiores a los pacientes con IC. Los médicos, los preparadores físicos y los equipos de rehabilitación cardiaca podrían usar estos resultados para elaborar programas de ejercicio específicos destinados a optimizar la función del corazón del paciente. Sin embargo, es preciso tener en cuenta también otras variables, como edad, frecuencia de las sesiones, duración del programa y tipo de recuperación. Así pues, el programa de EIAI debe adaptarse a las características individuales de cada paciente. La dosis recomendada en cada enfermedad se indica en la tabla 3. (Tabla 8)
Método |
Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (min) | Intervalo de Recuperación | Duración (semanas) | Porcentaje FCmax |
|---|---|---|---|---|---|---|---|
| HIIT | 10 min 50-60 % Vo2pico |
3 | 38 | 4 | 3 | 54 | 90-95% Vo2pico |
| MCT | 10 min 50-60 % Vo2pico |
5 | 40 | 0 | 0 | 54 | 60- 70% Vo2pico |
Método |
Pre base | Post 3 meses | Post 12 meses | P-value | DIF grupos | IC 95% | P-value |
|---|---|---|---|---|---|---|---|
| HITT | 21,1 (16,3–25,7) | 23,2 (17,7–28,7) | 19,6 (19,0–25,8) | P<0,639 | HIIT vs. MCT | -1,0 (-5,5-5,2) | P<0,548 |
| MCT | 17,4 (14,0–21,3) | 19,3 (14,3-25,1) | 20,6 (16,1–27,2) | P<0,001 | HIIT vs. GC | 0,0 (-0,1-1,5) | P<0,686 |
| CONTROL | 19,0 (14,5–22,1) | 20,0 (17,3–20,9) | 19,6 (16,5-23,3) | P<0,921 | MCT vs GC | 1,6 (-3,6-7,1) | P<0,001 |
Resultados en el Vo2max. Mean (SD)/Difference (95% CI.
Conclusiones.
El principal hallazgo de este estudio son los marcadores moleculares de atrofia muscular como MuRF1 y Trim72 se redujeron significativamente en SKM de pacientes con HFpEF después de 3 meses de HIIT. Estos efectos beneficiosos ya no se observaron después de 12 meses. Sólo la actividad del proteosoma se redujo significativamente mediante ET después de 12 meses. Las actividades de las enzimas mitocondriales y la expresión de los complejos de fosforilación oxidativa mitocondriales aumentaron significativamente con el HIIT después de 3 meses. Estos efectos ya no fueron detectables después de 12 meses de ET. El HIIT aumentó la cantidad de células satélite probablemente debido a una mayor capacidad de proliferación de estas células y su capacidad de diferenciación para generar miotubos. |
| Método | Calentamiento | Frecuencia semanal | Duración de Sesiones (min) | Intervalo de Trabajo (sg) | Intervalo de Recuperación (sg) |
Duración semanas |
Porcentaje Vo2max |
|---|---|---|---|---|---|---|---|
| HIIT | 10 MIN. 40% | 3 | 30 | 30 | 30 | 6 | 90% Vo2max |
| MCT | 10 MIN. 40% | 4 | 40 | 0 | 0 | 38 | 35-50% Vo2max |
Este método de HIIT está diseñado para ser altamente intenso, con períodos cortos de alta intensidad seguidos de períodos de recuperación igualmente cortos, lo que permite un entrenamiento eficaz en un tiempo relativamente corto.
Limitaciones
Heterogeneidad de los Estudios: Diferencias en los protocolos de HIIT dificultan la comparación directa entre estudios. Tamaño muestral y Diversidad de Participantes: Muestras pequeñas y diversidad en características de participantes pueden limitar la generalización. Falta de Grupos de Control Uniformes: Ausencia de grupos de control estandarizados dificulta atribuir precisamente beneficios al HIIT. Duración del seguimiento: La variabilidad en la duración del seguimiento afecta la comprensión a largo plazo. Falta de consenso en definiciones: Falta de consenso en términos introduce ambigüedad en la interpretación. Publicación Sesgada: Posibilidad de sesgo de publicación puede afectar la representación real. A pesar de estas limitaciones, la revisión proporciona una visión integral, destacando la importancia de abordar críticamente los resultados y señalando áreas para futuras investigaciones más específicas y estandarizadas.
Conflicto De Intereses
No se declaran conflictos.
Agradecimientos
A los autores de los trabajos originales mencionados en el presente estudio, que nos ayudaron proporcionándonos sus manuscritos o datos adicionales necesarios para esta revisión sistemática.
Bibliografia
2013 ACCF/AHA guideline for the management of heart failure. (2013, agosto 1). Sociedad Española de Cardiología. https://secardiologia.es/cientifico/guias-clinicas/insuficiencia-cardiaca-y-miocardiopatia/4828-2013-accfaha-guideline-for-the-management-of-heart-failure
Actividad física. (s/f). Who.int. Recuperado el 12 de febrero de 2024, de https://www.who.int/es/news-room/fact-sheets/detail/physical-activityAl
Habeeb, W., Tash, A., Elasfar, A., ALmasood, A., Bakhshi, A., Elshaer, F., Ayoubi, F. A., Alghalaini, K., Alqaseer, M., Alhussein, M., Almogbel, O., AlSaif, S., & AlHebeshi, Y. (2023). NHC/ SHA 2023 Focused update of the 2019 guidelines for the management of heart failure. Journal of the Saudi Heart Association, 35(1). https://doi.org/10.37616/2212-5043.1334
Ambrosetti, M., Abreu, A., Corrà, U., Davos, C. H., Hansen, D., Frederix, I., Iliou, M. C., Pedretti, R. F. E., Schmid, J.-P., Vigorito, C., Voller, H., Wilhelm, M., Piepoli, M. F., Bjarnason-Wehrens, B., Berger, T., Cohen-Solal, A., Cornelissen, V., Dendale, P., Doehner, W., … Zwisler, A.-D. O. (2021). Secondary prevention through comprehensive cardiovascular rehabilitation: From knowledge to implementation. 2020 update. A position paper from the Secondary Prevention and Rehabilitation Section of the European Association of Preventive Cardiology. European Journal of Preventive Cardiology, 28(5), 460–495. https://doi.org/10.1177/2047487320913379
Ames, M. K., Atkins, C. E., & Pitt, B. (2019). The renin‐angiotensin‐aldosterone system and its suppression. Journal of Veterinary Internal Medicine, 33(2), 363–382. https://doi.org/10.1111/jvim.15454
Anderson, L., Oldridge, N., Thompson, D. R., Zwisler, A.-D., Rees, K., Martin, N., & Taylor, R. S. (2016). Exercise-based cardiac rehabilitation for coronary heart disease. Journal of the American College of Cardiology, 67(1), 1–12. https://doi.org/10.1016/j.jacc.2015.10.044
Angadi, S. S., Mookadam, F., Lee, C. D., Tucker, W. J., Haykowsky, M. J., & Gaesser, G. A. (2015). High-intensity interval training vs. moderate-intensity continuous exercise training in heart failure with preserved ejection fraction: a pilot study. Journal of Applied Physiology (Bethesda, Md.: 1985), 119(6), 753–758. https://doi.org/10.1152/japplphysiol.00518.2014
Assessing national capacity for the prevention and control of noncommunicable diseases: report of the 2019 global survey. (2020, marzo 17). Who.int; World Health Organization. https://www.who.int/publications/i/item/9789240002319
Barge-Caballero, E., Barge-Caballero, G., Couto-Mallón, D., Paniagua-Martín, M. J., Marzoa-Rivas, R., Naya-Leira, C., Riveiro-Rodríguez, C. M., Grille-Cancela, Z., Blanco-Canosa, P., Muñiz, J., Vázquez-Rodríguez, J. M., & Crespo-Leiro, M. G. (2020). Comparación de mortalidad pronosticada y mortalidad observada en pacientes con insuficiencia cardiaca tratados en una unidad clínica especializada. Revista espanola de cardiologia, 73(8), 652–659. https://doi.org/10.1016/j.recesp.2019.09.016
Bauersachs, J., de Boer, R. A., Lindenfeld, J., & Bozkurt, B. (2022). The year in cardiovascular medicine 2021: heart failure and cardiomyopathies. European Heart Journal, 43(5), 367–376. https://doi.org/10.1093/eurheartj/ehab887
Besnier, F., Labrunée, M., Richard, L., Faggianelli, F., Kerros, H., Soukarié, L., Bousquet, M., Garcia, J.-L., Pathak, A., Gales, C., Guiraud, T., & Sénard, J. M. (2019). Short-term effects of a 3-week interval training program on heart rate variability in chronic heart failure. A randomised controlled trial. Annals of Physical and Rehabilitation Medicine, 62(5), 321–328. https://doi.org/10.1016/j.rehab.2019.06.013
Bingel, A., Messroghli, D., Weimar, A., Runte, K., Salcher-Konrad, M., Kelle, S., Pieske, B., Berger, F., Kuehne, T., Goubergrits, L., Fuerstenau, D., & Kelm, M. (2022). Hemodynamic changes during physiological and pharmacological stress testing in patients with heart failure: A systematic review and meta-analysis. Frontiers in cardiovascular medicine, 9. https://doi.org/10.3389/fcvm.2022.718114
Blond, K., Brinkløv, C. F., Ried-Larsen, M., Crippa, A., & Grøntved, A. (2020). Association of high amounts of physical activity with mortality risk: a systematic review and meta-analysis. British Journal of Sports Medicine, 54(20), 1195–1201. https://doi.org/10.1136/bjsports-2018-100393
Bozkurt, B., Coats, A. J. S., Tsutsui, H., Abdelhamid, C. M., Adamopoulos, S., Albert, N., Anker, S. D., Atherton, J., Böhm, M., Butler, J., Drazner, M. H., Michael Felker, G., Filippatos, G., Fiuzat, M., Fonarow, G. C., Gomez-Mesa, J.-E., Heidenreich, P., Imamura, T., Jankowska, E. A., … Zieroth, S. (2021). Universal definition and classification of heart failure: A report of the heart failure society of America, heart failure association of the European society of cardiology, Japanese heart failure society and writing committee of the universal definition of heart failure: Endorsed by the Canadian heart failure society, heart failure association of India, cardiac society of Australia and New Zealand, and Chinese heart failure association. European Journal of Heart Failure, 23(3), 352–380. https://doi.org/10.1002/ejhf.2115
Brooks, E. R., Benson, A. C., Fox, A. S., & Bruce, L. M. (2021). Movement intensity demands between training activities and competition for elite female netballers. PloS One, 16(4), e0249679. https://doi.org/10.1371/journal.pone.0249679
Brown, D. A., Perry, J. B., Allen, M. E., Sabbah, H. N., Stauffer, B. L., Shaikh, S. R., Cleland, J. G. F., Colucci, W. S., Butler, J., Voors, A. A., Anker, S. D., Pitt, B., Pieske, B., Filippatos, G., Greene, S. J., & Gheorghiade, M. (2017). Mitochondrial function as a therapeutic target in heart failure. Nature Reviews. Cardiology, 14(4), 238–250. https://doi.org/10.1038/nrcardio.2016.203
Caruso, F. R., Junior, J. C. B., Mendes, R. G., Sperling, M. P., Arakelian, V. M., Bassi, D., Arena, R., & Borghi-Silva, A. (2016). Hemodynamic and metabolic response during dynamic and resistance exercise in different intensities: a cross-sectional study on implications of intensity on safety and symptoms in patients with coronary disease. American Journal of Cardiovascular Disease, 6(2), 36–45
Casado, A., González-Mohíno, F., González-Ravé, J. M., & Foster, C. (2022). Training periodization, methods, intensity distribution, and volume in highly trained and elite distance runners: A systematic review. International journal of sports physiology and performance, 17(6), 820–833. https://doi.org/10.1123/ijspp.2021-0435
Cattadori, G., Segurini, C., Picozzi, A., Padeletti, L., & Anzà, C. (2018). Exercise and heart failure: an update. ESC heart failure, 5(2), 222-232.
Chung, M. L., Park, L., Frazier, S. K., & Lennie, T. A. (2017). Long-term adherence to low-sodium diet in patients with heart failure. Western Journal of Nursing Research, 39(4), 553–567. https://doi.org/10.1177/0193945916681003
Currie, K. D., Dizonno, V., Oh, P. I., & Goodman, J. M. (2023). Acute physiological responses to high-intensity interval exercise in patients with coronary artery disease. European Journal of Applied Physiology, 123(4), 737–747. https://doi.org/10.1007/s00421-022-05102-2
Cuende, J. I. (2016). Vascular age versus cardiovascular risk: Clarifying concepts. Revista espanola de cardiologia (English ed.), 69(3), 243-246.
Desgorces, F.-D. (2023). About exercise control in studies on high-intensity interval exercise. European Journal of Applied Physiology, 123(8), 1863–1864. https://doi.org/10.1007/s00421-023-05217-0
Directrices del ACSM para pruebas de ejercicio y prescripción. (2021). Wolters Kluwer Salud.
Donelli da Silveira, A., Beust de Lima, J., da Silva Piardi, D., dos Santos Macedo, D., Zanini, M., Nery, R., Laukkanen, J. A., & Stein, R. (2020). High-intensity interval training is effective and superior to moderate continuous training in patients with heart failure with preserved ejection fraction: A randomized clinical trial. European Journal of Preventive Cardiology, 27(16), 1733–1743. https://doi.org/10.1177/2047487319901206
Edwards, J., Shanmugam, N., Ray, R., Jouhra, F., Mancio, J., Wiles, J., Marciniak, A., Sharma, R., & O’Driscoll, J. (2023). Exercise mode in heart failure: A systematic review and meta-analysis. Sports Medicine - Open, 9(1). https://doi.org/10.1186/s40798-022-00549-1
Ellingsen, Ø., Halle, M., Conraads, V., Støylen, A., Dalen, H., Delagardelle, C., Larsen, A.-I., Hole, T., Mezzani, A., Van Craenenbroeck, E. M., Videm, V., Beckers, P., Christle, J. W., Winzer, E., Mangner, N., Woitek, F., Höllriegel, R., Pressler, A., Monk-Hansen, T., … Linke, A. (2017). High-intensity interval training in patients with heart failure with reduced ejection fraction. Circulation, 135(9), 839–849. https://doi.org/10.1161/circulationaha.116.022924
Ezekowitz, J. A., O’Meara, E., McDonald, M. A., Abrams, H., Chan, M., Ducharme, A., Giannetti, N., Grzeslo, A., Hamilton, P. G., Heckman, G. A., Howlett, J. G., Koshman, S. L., Lepage, S., McKelvie, R. S., Moe, G. W., Rajda, M., Swiggum, E., Virani, S. A., Zieroth, S., … Sussex, B. (2017). 2017 comprehensive update of the Canadian cardiovascular society guidelines for the management of heart failure. The Canadian Journal of Cardiology, 33(11), 1342–1433. https://doi.org/10.1016/j.cjca.2017.08.022
Fernández-Vázquez, D., Ferrero-Gregori, A., Álvarez-García, J., Gómez-Otero, I., Vázquez, R., Delgado Jiménez, J., Worner Diz, F., Bardají, A., García-Pavía, P., Bayés-Genís, A., González-Juanatey, J. R., Cinca, J., & Pascual Figal, D. A. (2020). Cambio en la causa de muerte e influencia de la mejora terapéutica con el tiempo en pacientes con insuficiencia cardiaca y fracción de eyección reducida. Revista espanola de cardiologia, 73(7), 561–568. https://doi.org/10.1016/j.recesp.2019.09.012
Geidl, W., Abu-Omar, K., Weege, M., Messing, S., & Pfeifer, K. (2020). German recommendations for physical activity and physical activity promotion in adults with noncommunicable diseases. The International Journal of Behavioral Nutrition and Physical Activity, 17(1), 12. https://doi.org/10.1186/s12966-020-0919-x
Gerlach, S., Mermier, C., Kravitz, L., Degnan, J., Dalleck, L., & Zuhl, M. (2020). Comparison of treadmill and cycle ergometer exercise during cardiac rehabilitation: A meta-analysis. Archives of Physical Medicine and Rehabilitation, 101(4), 690–699. https://doi.org/10.1016/j.apmr.2019.10.184
Gibala, M. J. (2021). Physiological basis of interval training for performance enhancement. Experimental Physiology, 106(12), 2324–2327. https://doi.org/10.1113/ep088190
Groenewegen, A., Rutten, F. H., Mosterd, A., & Hoes, A. W. (2020). Epidemiology of heart failure. European Journal of Heart Failure, 22(8), 1342–1356. https://doi.org/10.1002/ejhf.1858
Guazzi, M., Wilhelm, M., Halle, M., Van Craenenbroeck, E., Kemps, H., de Boer, R. A., Coats, A. J. S., Lund, L., Mancini, D., Borlaug, B., Filippatos, G., & Pieske, B. (2022). Exercise testing in heart failure with preserved ejection fraction: an appraisal through diagnosis, pathophysiology and therapy – A clinical consensus statement of the Heart Failure Association and European Association of Preventive Cardiology of the European Society of Cardiology. European Journal of Heart Failure, 24(8), 1327–1345. https://doi.org/10.1002/ejhf.2601
Guha, S., Harikrishnan, S., Ray, S., Sethi, R., Ramakrishnan, S., Banerjee, S., Bahl, V. K., Goswami, K. C., Banerjee, A. K., Shanmugasundaram, S., Kerkar, P. G., Seth, S., Yadav, R., Kapoor, A., Mahajan, A. U., Mohanan, P. P., Mishra, S., Deb, P. K., Narasimhan, C., … Lokhandwala, Y. (2018). CSI position statement on management of heart failure in India. Indian Heart Journal, 70, S1–S72. https://doi.org/10.1016/j.ihj.2018.05.003
Hansen, D., Abreu, A., Ambrosetti, M., Cornelissen, V., Gevaert, A., Kemps, H., Laukkanen, J. A., Pedretti, R., Simonenko, M., Wilhelm, M., Davos, C. H., Reviewers:, Doehner, W., Iliou, M.-C., Kränkel, N., Völler, H., & Piepoli, M. (2022). Exercise intensity assessment and prescription in cardiovascular rehabilitation and beyond: why and how: a position statement from the Secondary Prevention and Rehabilitation Section of the European Association of Preventive Cardiology. European Journal of Preventive Cardiology, 29(1), 230–245. https://doi.org/10.1093/eurjpc/zwab007
Hanson, N. J., Scheadler, C. M., Lee, T. L., Neuenfeldt, N. C., Michael, T. J., & Miller, M. G. (2016). Modality determines VO2max achieved in self-paced exercise tests: validation with the Bruce protocol. European Journal of Applied Physiology, 116(7), 1313–1319. https://doi.org/10.1007/s00421-016-3384-0
Heidenreich, P. A., Bozkurt, B., Aguilar, D., Allen, L. A., Byun, J. J., Colvin, M. M., Deswal, A., Drazner, M. H., Dunlay, S. M., Evers, L. R., Fang, J. C., Fedson, S. E., Fonarow, G. C., Hayek, S. S., Hernandez, A. F., Khazanie, P., Kittleson, M. M., Lee, C. S., Link, M. S., … Yancy, C. W. (2022). 2022 AHA/ACC/HFSA guideline for the Management of Heart Failure: Executive summary: A report of the American College of Cardiology/American Heart Association joint committee on clinical practice guidelines. Circulation, 145(18). https://doi.org/10.1161/cir.0000000000001062
Huertas, J. R., Casuso, R. A., Agustín, P. H., & Cogliati, S. (2019). Stay fit, stay young: Mitochondria in movement: The role of exercise in the new mitochondrial paradigm. Oxidative Medicine and Cellular Longevity, 2019, 1–18. https://doi.org/10.1155/2019/7058350
Informe científico del Comité Asesor de Directrices de Actividad Física 2018. (2018).
Insuficiencia cardíaca con función preservada. Revisión del tema y comunicación de la experiencia española. (2017). Revista uruguaya de cardiología, 32(3). https://doi.org/10.29277/ruc/32.3.15
Ito, S. (2019). High-intensity interval training for health benefits and care of cardiac diseases - The key to an efficient exercise protocol. World journal of cardiology, 11(7), 171–188. https://doi.org/10.4330/wjc.v11.i7.171}
Järvinen, L., Lundin Petersdotter, S., & Chaillou, T. (2022). High-intensity resistance exercise is not as effectiveas traditional high-intensity interval exercise for increasing the cardiorespiratory response and energy expenditure in recreationally active subjects. European Journal of Applied Physiology, 122(2), 459–474. https://doi.org/10.1007/s00421-021-04849-4
Karatzanos, E., Ferentinos, P., Mitsiou, G., Dimopoulos, S., Ntalianis, A., & Nanas, S. (2021). Acute cardiorespiratory responses to different exercise modalities in chronic heart failure patients—A pilot study. Journal of Cardiovascular Development and Disease, 8(12), 164. https://doi.org/10.3390/jcdd8120164
King, A. C., Powell, K. E., & Kraus, W. E. (2019). The US physical activity guidelines advisory committee report-introduction. Medicine and Science in Sports and Exercise, 51(6), 1203–1205. https://doi.org/10.1249/MSS.0000000000001946
Koppen, E., Omland, T., Larsen, A. I., Karlsen, T., Linke, A., Prescott, E., Halle, M., Dalen, H., Delagardelle, C., Hole, T., van Craenenbroeck, E. M., Beckers, P., Ellingsen, Ø., Feiereisen, P., Valborgland, T., Videm, V., & SMARTEX-HF Study Group. (2021). Exercise training and high‐sensitivity cardiac troponin T in patients with heart failure with reduced ejection fraction. ESC Heart Failure, 8(3), 2183–2192. https://doi.org/10.1002/ehf2.13310
Kourek, C., Alshamari, M., Mitsiou, G., Psarra, K., Delis, D., Linardatou, V., Pittaras, T., Ntalianis, A., Papadopoulos, C., Panagopoulou, N., Vasileiadis, I., Nanas, S., & Karatzanos, E. (2021). The acute and long-term effects of a cardiac rehabilitation program on endothelial progenitor cells in chronic heart failure patients: Comparing two different exercise training protocols. International Journal of Cardiology. Heart & Vasculature, 32(100702), 100702. https://doi.org/10.1016/j.ijcha.2020.100702
Kristiansen, J., Sjúrðarson, T., Grove, E. L., Rasmussen, J., Kristensen, S. D., Hvas, A.-M., & Mohr, M. (2022). Feasibility and impact of whole-body high-intensity interval training in patients with stable coronary artery disease: a randomised controlled trial. Scientific Reports, 12(1). https://doi.org/10.1038/s41598-022-21655-w
Long, L., Mordi, I. R., Bridges, C., Sagar, V. A., Davies, E. J., Coats, A. J. S., Dalal, H., Rees, K., Singh, S. J., & Taylor, R. S. (2019). Exercise-based cardiac rehabilitation for adults with heart failure. The Cochrane Library, 2019(1). https://doi.org/10.1002/14651858.cd003331.pub5
Lopez, P., Radaelli, R., Taaffe, D. R., Galvão, D. A., Newton, R. U., Nonemacher, E. R., Wendt, V. M., Bassanesi, R. N., Turella, D. J. P., & Rech, A. (2022). Moderators of resistance training effects in overweight and obese adults: A systematic review and meta-analysis. Medicine and Science in Sports and Exercise, 54(11), 1804–1816. https://doi.org/10.1249/MSS.0000000000002984
Lum, D., Joseph, R., Ong, K. Y., Tang, J. M., & Suchomel, T. J. (2023). Comparing the effects of long-term vs. Periodic inclusion of isometric strength training on strength and dynamic performances. Journal of Strength and Conditioning Research, 37(2), 305–314. https://doi.org/10.1519/jsc.0000000000004276
Mahatme, S., Vaishali, Kumar, N., Rao, V., Kovela, R. K., & Sinha, M. K. (2022). Impact of high-intensity interval training on cardio-metabolic health outcomes and mitochondrial function in older adults: a review. Medicine and pharmacy reports. https://doi.org/10.15386/mpr-2201
McGregor, G., Powell, R., Begg, B., Birkett, S. T., Nichols, S., Ennis, S., McGuire, S., Prosser, J., Fiassam, O., Hee, S. W., Hamborg, T., Banerjee, P., Hartfiel, N., Charles, J. M., Edwards, R. T., Drane, A., Ali, D., Osman, F., He, H., … Shave, R. (2023). High-intensity interval training in cardiac rehabilitation: a multi-centre randomized controlled trial. European Journal of Preventive Cardiology, 30(9), 745–755. https://doi.org/10.1093/eurjpc/zwad039
Michalska-Kasiczak, M., Bielecka-Dabrowa, A., von Haehling, S., Anker, S. D., Rysz, J., & Banach, M. (2018). Biomarkers, myocardial fibrosis and co-morbidities in heart failure with preserved ejection fraction: an overview. Archives of medical science: AMS, 14(4), 890–909. https://doi.org/10.5114/aoms.2018.76279
Mueller, S., Winzer, E. B., Duvinage, A., Gevaert, A. B., Edelmann, F., Haller, B., Pieske-Kraigher, E., Beckers, P., Bobenko, A., Hommel, J., Van de Heyning, C. M., Esefeld, K., von Korn, P., Christle, J. W., Haykowsky, M. J., Linke, A., Wisløff, U., Adams, V., Pieske, B., … OptimEx-Clin Study Group. (2021). Effect of high-intensity interval training, moderate continuous training, or guideline-based physical activity advice on peak oxygen consumption in patients with heart failure with preserved ejection fraction: A randomized clinical trial. JAMA: The Journal of the American Medical Association, 325(6), 542. https://doi.org/10.1001/jama.2020.26812
Nunnari J, Suomalainen A. Mitochondria: in sickness and in health. Cell. 2012 Mar 16;148(6):1145-59. doi: 10.1016/j.cell.2012.02.035. PMID: 22424226; PMCID: PMC5381524.
O’Connor, C. M., Whellan, D. J., Lee, K. L., Keteyian, S. J., Cooper, L. S., Ellis, S. J., Leifer, E. S., Kraus, W. E., Kitzman, D. W., Blumenthal, J. A., Rendall, D. S., Miller, N. H., Fleg, J. L., Schulman, K. A., McKelvie, R. S., Zannad, F., Piña, I. L., & for the HF-ACTION Investigators. (2009). Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA: The Journal of the American Medical Association, 301(14), 1439. https://doi.org/10.1001/jama.2009.454
Orozco-Beltrán, D., Brotons Cuixart, C., Banegas Banegas, J. R., Gil Guillén, V. F., Cebrián Cuenca, A. M., Martín Rioboó, E., Jordá Baldó, A., Vicuña, J., & Navarro Pérez, J. (2022). Recomendaciones preventivas cardiovasculares. Actualización PAPPS 2022. Atencion primaria, 54(102444), 102444. https://doi.org/10.1016/j.aprim.2022.102444
Page, M. J., McKenzie, J. E., Bossuyt, P. M., Boutron, I., Hoffmann, T. C., Mulrow, C. D., Shamseer, L., Tetzlaff, J. M., Akl, E. A., Brennan, S. E., Chou, R., Glanville, J., Grimshaw, J. M., Hróbjartsson, A., Lalu, M. M., Li, T., Loder, E. W., Mayo-Wilson, E., McDonald, S., … Alonso-Fernández, S. (2021). Declaración PRISMA 2020: una guía actualizada para la publicación de revisiones sistemáticas. Revista espanola de cardiologia, 74(9), 790–799. https://doi.org/10.1016/j.recesp.2021.06.016
Pascual-Figal, D. A., Casademont, J., Lobos, J. M., Piñera, P., Bayés-Genis, A., Ordóñez-Llanos, J., & González-Juanatey, J. R. (2016). Documento de consenso y recomendaciones sobre el uso de los péptidos natriuréticos en la práctica clínica. Revista clinica espanola, 216(6), 313–322. https://doi.org/10.1016/j.rce.2016.02.008
Pelliccia, A., Sharma, S., Gati, S., Bäck, M., Börjesson, M., Caselli, S., Collet, J.-P., Corrado, D., Drezner, J. A., Halle, M., Hansen, D., Heidbuchel, H., Myers, J., Niebauer, J., Papadakis, M., Piepoli, M. F., Prescott, E., Roos-Hesselink, J. W., Stuart, A. G., … Wilhelm, M. (2021). Guía ESC 2020 sobre cardiología del deporte y el ejercicio en pacientes con enfermedad cardiovascular. Revista espanola de cardiologia, 74(6), 545.e1-545.e73. https://doi.org/10.1016/j.recesp.2020.11.026
Quindry, J. C., Franklin, B. A., Chapman, M., Humphrey, R., & Mathis, S. (2019). Benefits and risks of high-intensity interval training in patients with coronary artery disease. The American Journal of Cardiology, 123(8), 1370–1377. https://doi.org/10.1016/j.amjcard.2019.01.008
Ramsey, K. A., Rojer, A. G. M., D’Andrea, L., Otten, R. H. J., Heymans, M. W., Trappenburg, M. C., Verlaan, S., Whittaker, A. C., Meskers, C. G. M., & Maier, A. B. (2021). The association of objectively measured physical activity and sedentary behavior with skeletal muscle strength and muscle power in older adults: A systematic review and meta-analysis. Ageing Research Reviews, 67(101266), 101266. https://doi.org/10.1016/j.arr.2021.101266
Reddy, Y. N. V., Carter, R. E., Obokata, M., Redfield, M. M., & Borlaug, B. A. (2018). A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation, 138(9), 861–870. https://doi.org/10.1161/circulationaha.118.034646
Redfield, M. M., & Borlaug, B. A. (2023). Heart failure with preserved ejection fraction: A review. JAMA: The Journal of the American Medical Association, 329(10), 827. https://doi.org/10.1001/jama.2023.2020
Saito, Y., Obokata, M., Harada, T., Kagami, K., Wada, N., Okumura, Y., & Ishii, H. (2023). Prognostic benefit of early diagnosis with exercise stress testing in heart failure with preserved ejection fraction. European Journal of Preventive Cardiology, 30(9), 902–911. https://doi.org/10.1093/eurjpc/zwad127
Singam, N. S. V., Fine, C., & Fleg, J. L. (2020). Cardiac changes associated with vascular aging. Clinical Cardiology, 43(2), 92–98. https://doi.org/10.1002/clc.23313
Sokolska, J. M., Sokolski, M., Zymliński, R., Biegus, J., Siwołowski, P., Nawrocka-Millward, S., Jankowska, E. A., Todd, J., Banasiak, W., & Ponikowski, P. (2019). Patterns of dyspnoea onset in patients with acute heart failure: clinical and prognostic implications. ESC Heart Failure, 6(1), 16–26. https://doi.org/10.1002/ehf2.12371
Stamatakis, E., Ahmadi, M. N., Gill, J. M. R., Thøgersen-Ntoumani, C., Gibala, M. J., Doherty, A., & Hamer, M. (2022). Association of wearable device-measured vigorous intermittent lifestyle physical activity with mortality. Nature Medicine, 28(12), 2521–2529. https://doi.org/10.1038/s41591-022-02100-x
Sultana, R. N., Sabag, A., Keating, S. E., & Johnson, N. A. (2019). The effect of low-volume high-intensity interval training on body composition and cardiorespiratory fitness: A systematic review and meta-analysis. Sports Medicine (Auckland, N.Z.), 49(11), 1687–1721. https://doi.org/10.1007/s40279-019-01167-w
Thurlow, F., Weakley, J., Townshend, A. D., Timmins, R. G., Morrison, M., & McLaren, S. J. (2023). The acute demands of repeated-sprint training on physiological, neuromuscular, perceptual and performance outcomes in team sport athletes: A systematic review and meta-analysis. Sports Medicine (Auckland, N.Z.), 53(8), 1609–1640. https://doi.org/10.1007/s40279-023-01853-w
Turri-Silva, N., Vale-Lira, A., Verboven, K., Quaglioti Durigan, J. L., Hansen, D., & Cipriano, G. (2021). High-intensity interval training versus progressive high-intensity circuit resistance training on endothelial function and cardiorespiratory fitness in heart failure: A preliminary randomized controlled trial. PloS One, 16(10), e0257607. https://doi.org/10.1371/journal.pone.0257607
Tzanis, G., Philippou, A., Karatzanos, E., Dimopoulos, S., Kaldara, E., Nana, E., Pitsolis, T., Rontogianni, D., Koutsilieris, M., & Nanas, S. (2017). Effects of high-intensity interval exercise training on skeletal myopathy of chronic heart failure. Journal of Cardiac Failure, 23(1), 36–46. https://doi.org/10.1016/j.cardfail.2016.06.007
Winzer, E. B., Augstein, A., Schauer, A., Mueller, S., Fischer-Schaepmann, T., Goto, K., Hommel, J., van Craenenbroeck, E. M., Wisløff, U., Pieske, B., Halle, M., Linke, A., & Adams, V. (2022). Impact of different training modalities on molecular alterations in skeletal muscle of patients with heart failure with preserved ejection fraction: A substudy of the OptimEx trial. Circulation. Heart Failure, 15(10). https://doi.org/10.1161/circheartfailure.121.009124
Yin, M., Chen, Z., Nassis, G. P., Liu, H., Li, H., Deng, J., & Li, Y. (2023). Chronic high-intensity interval training and moderate-intensity continuous training are both effective in increasing maximum fat oxidation during exercise in overweight and obese adults: A meta-analysis. Journal of Exercise Science and Fitness, 21(4), 354–365. https://doi.org/10.1016/j.jesf.2023.08.001
Zhu, X., Wang, S., Cheng, Y., Gu, H., Zhang, X., Teng, M., Zhang, Y., Wang, J., Hua, W., & Lu, X. (2023). Physiological ischemic training improves cardiac function through the attenuation of cardiomyocyte apoptosis and the activation of the vagus nerve in chronic heart failure. Frontiers in neuroscience, 17. https://doi.org/10.3389/fnins.2023.1174455.